Pizza ha scritto:
Resina acida
R- H+ +Na+ ----> R-Na+ +H+
2R-Na+ + Ca2+ -----> R2-Ca2+ + 2Na+
Prima di scrivere che la riduzione della durezza temporanea (KH) sono solo per distruzione dell'anione bicarbonato, ti sei chiesto perché le misurazioni del GH prima e dopo filtrazione diminuiscono?
Le due reazioni che hai scritto avvalorano la mia tesi (la resina gli fa una pippa al sodio contenuto nell'acqua), infatti moltiplicando la prima reazione per 2 e sommando membro a membro, la reazione netta è:
2R-H + 2Ca++ +> R-Ca-R + 2H+
quindi il Na+, come dicevo io, passa indisturbato, e il Ca++ resta bloccato sulla resina (infatti anche tu hai scritto "le misurazioni del GH prima e dopo filtrazione diminuiscono")
La mia tesi è molto semplice: in un'acqua contenente decine di ioni, tra cui Na+, K+, Ca++ e Mg++, questi ultimi si legheranno preferibilmente rispetto al sodio e al potassio, sia perchè in quantità maggiori (in molte acqua prelevate da rete idrica la somma di Ca e Mg è 10 volte la somma di sodio e potassio), sia perchè con maggiore affinità elettrostatica (doppia carica positiva) nei confronti della resina carica negativamente, come testimoniato anche da questa tabella.
scambio cationico: Ba++>Ca++>Ni++>Cu++>Mg++>Ag+>Rb+>Cs+>K+>NH4+>Na+>H+>Li+
Dimostrazione: analisi in cromatografia ionica di una miscela di cationi
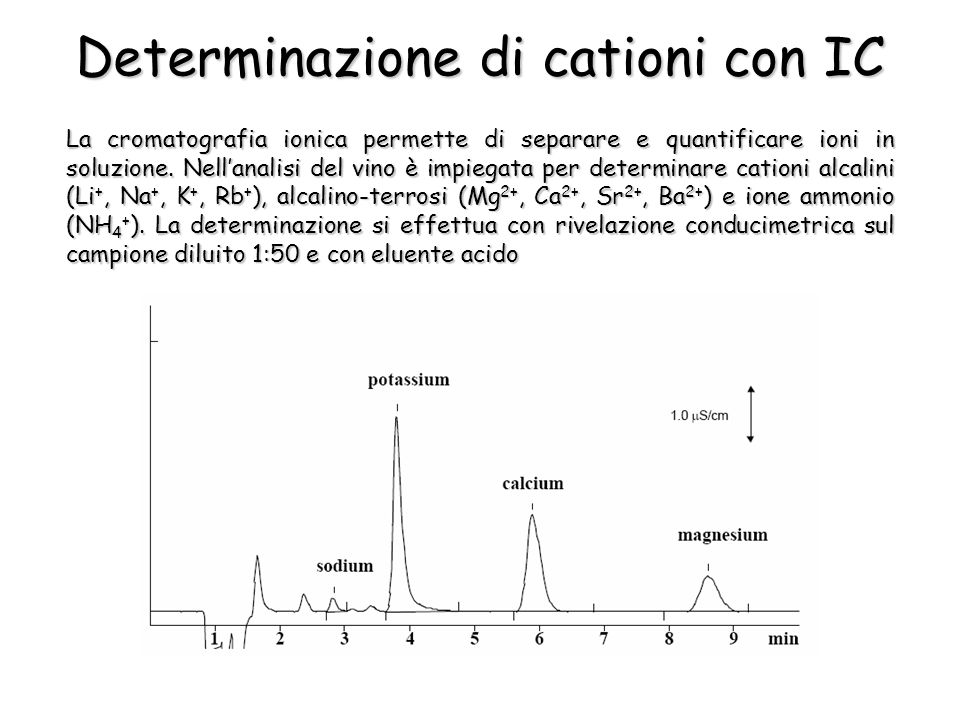
sodio e potassio sono i meno trattenuti dalla resina cationica, infatti escono per primi. Ca e Mg, che hanno affinità maggiore per la resina, escono per ultimi.
Il senso della tabella del powerpoint riportato da lucazio è proprio questo: quali cationi sono maggiormente trattenuti da una resina cationica?
Ba, Ca, Ni, Cu++ e Mg++, sono i più trattenuti, infatti escono per ultimi, mentre K+ NH+ Na+ e Li+, meno trattenuti perchè con minore affinità, escono per primi (il sodio fa bye bye alla resina cationica ed esce velocemente da essa).
E questo è un dato di fatto, è scienza, non è l'opinione di un produttore di caraffe o un stralcio di un articolo tratto da wikipedia, da un blog o da un forum. Se vogliamo dibattare anche su questo, allora dobbiamo rivedere tutti i corsi universitari di chimica analitica, e demolire le migliaia di cromatogri ionici sparsi per il mondo che in questo preciso momento stanno analizzando acque, campioni alimentari e ambientali

Dimostrazione bis: analisi in cromatografia ionica di una miscela di anioni
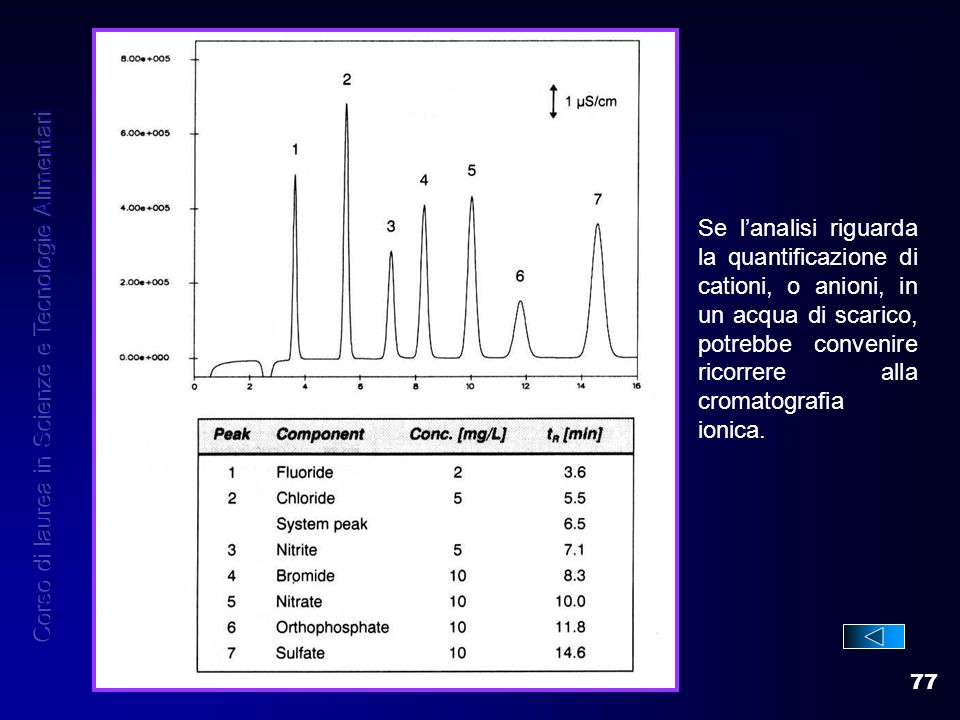
anche stavolta, gli ioni a carica singola (fluoruro e cloruro) escono per primi (picchi 1 e 2) mentre gli anioni a carica multipla (nitrato, solfato e fosfato, picchi 5,6 e 7) escono per ultimi perchè più trattenuti dalla resina.
Non solo...a parità di carica elettrica (-1) gli ioni più piccoli (fluoruro e cloruro) sono meno trattenuti rispetto agli ioni più grandi (bromuro e nitrito, picchi 3 e 4).
PS: la teoria degli orbitali si applica ai legami covalenti (omopolare o eteropolare).
Non esistono solo i legami covalenti, ovvio, ma tra uno ione a carica positiva e uno a carica negativa, che tipo di interazioni vuoi che ci sia? Sovrapposizione di orbitali atomici (che neanche si possono chiamare "atomici", perchè non si tratta di atomi, ma di ioni) con formazione di un legame covalente?
Lo scambio cationico va solo discusso in termini di interazioni elettrostatiche tra ioni di segno opposto; gli orbitali atomici non c'entrano assolutamente niente.







